部分酸化反応においてガス状の水素は、イオンの導体である膜を通過して陰極に到達する水素イオンと、外部回路を経由して陰極に到達する電子とを発生させる。部分還元反応において、陰極を通って流れ込んだ空気から供給された酸素は、これらの水素イオン及び電子と結びつき水と余剰熱を発生させる。これら2つの部分反応は、ポリマー電解質膜燃料電池の中で、通常80℃の低い稼動温度で非常にゆっくりと進行する。触媒はこのように、各部分反応の効果を高めるため陽極と陰極の両方で使用される。各電極で最高の働きをする触媒は非常に高価な材料の白金である。電池のすべての反応の最終生産物は出力、水および余剰熱である。燃料電池の温度を80℃に維持するために、実際には冷却が必要とされる。この温度で、陰極で生成された水は液体と蒸気の両方である。この生成水は空気の流れにより燃料電池の外に運び出される。
燃料電池の電気化学反応
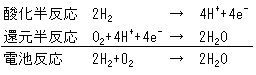
両電極で発生する物理的および電気化学的プロセスは非常に複雑である。陽極において、水素ガス(H2)は白金(Pt)と遭遇するまで曲がりくねった道を通って拡散しなければならない。白金は水素分子を、2つの近接した白金原子に結びついた2つの水素原子(H)へと分離する触媒の役目を果たす。その時にだけ、各水素原子は木素イオン(H+)を作るために電子を解放することができる。電子が陽極から外部の回路を経て陰極に到達する間にこれらの水素イオンが膜を通過して陰極に導かれる時、回路に電流が流れる。
陰極での1個の酸素(O2)分子の反応は4個の電子還元プロセス(上記の方程式参照)であり、多段階の連鎖の中で発生する。ポリマー電解質膜燃料電池が稼動する比較的低い温度(摂氏80度まで)で酸素還元の高い効率を得られる唯一の触媒は、高価な白金に基づく触媒しかないと考えられている。この複雑なプロセスやメカニズムに関しては依然として不確実な部分がある。ポリマー電解質膜燃料電池の効率は本来、水素の部分酸化反応より100倍以上遅い酸素の部分還元反応のスピードにより制限されている。