|
d. 水中オキシダント濃度(オゾン換算)
表II.2.1-8には、水中オキシダント濃度(オゾン換算、以下同じ)の分析方法であるヨウ素滴定法(KI法)の手順を示した。写真II.2.1-5には、ヨウ素滴定法による水中オキシダント濃度分析風景を掲載した。また、表II.2.1-9には、水中のオキシダント濃度分析時間を示した。
この方法は、オゾンの作用で遊離したヨウ化カリウム(KI)の量を滴定により分析し、その量からオキシダント濃度を算出するものである。
分析時間は、オゾン注入から45秒後、5分45秒後、10分45秒後、1時間45秒後、6時間45秒後、24時間、48時間、72時間及び120時間である。
表II.2.1-8 ヨウ素滴定法(KI法)の分析手順
(1)あらかじめヨウ化カリウム2gを入れた100 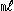 共栓メスフラスコに、試験水50 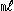 をピペットで入れる (2)共栓メスフラスコを静かに振り、ヨウ化カリウムを溶解する。
(3)硫酸5 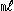 を添加し混合する。 (4)栓をし暗所に5分間静置する。
(5)蒸留水で100 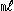 に定容し、300  三角フラスコに移す。 (6)遊離ヨウ素を0.005mol/  チオ硫酸ナトリウム溶液で滴定し、溶液の黄色が薄くなったのを確認後、1%デンプン指示薬を1  添加する。 (7)ヨウ素デンプンの青色が消えるまで再滴定する(滴定量:a  ) (8)オゾンを注入しない未処理原水について(1)〜(7)の方法で滴定する(滴定量:b 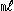 ) (9)下式によりオキシダント濃度を計算する。
処理水オキシダント濃度(mg/ 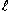 )=a×f×0.120×1000/検水量( 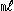 ) 未処理水オキシダント濃度(mg/ 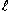 )=b×f×0.120×1000/検水量( 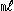 ) f: チオ硫酸ナトリウムのファクター(0.998)
|
|
| 写真II.2.1-5 |
ヨウ素滴定法による水中オキシダント濃度(オゾン換算)分析風景 |
| 表II.2.1-9 |
水中のオキシダント濃度(オゾン換算)分析時間(○印) |
| 注入時のオゾン濃度 |
2.5mg/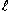 |
| スリット部流速 |
40m/sec |
30 m/sec |
| オゾン注入位置 |
スリットの上流 |
スリットの下流 |
スリットの上流 |
| オゾン注入から45秒後 |
○ |
○ |
○ |
| 〃 5分45秒後 |
○ |
○ |
○ |
| 〃 10分45秒後 |
○ |
○ |
○ |
| 〃 1時間45秒後 |
○ |
○ |
○ |
| 〃 6時間45秒後 |
○ |
○ |
○ |
| 〃 24時間後 |
○ |
○ |
○ |
| 〃 48時間後 |
○ |
○ |
○ |
| 〃 72時間後 |
○ |
○ |
○ |
| 〃 120時間後 |
○ |
○ |
○ |
| 未処理水 |
○ |
○ |
○ |
|
e. 溶存有機炭素(DOC)
溶存有機炭素は、水中の懸濁物質に由来する懸濁態有機炭素をろ過で除去したろ液中の有機炭素である。ろ過に使用するフィルターは、450℃で数時間燃焼処理を行ったグラスファイバーフィルター(Whatman社製GF/F)を用いた。ろ過処理したろ液は、ポリビンに収納しDOCの分析サンプルとした。DOCの分析は、乾式高温燃焼式TOC分析計により行った。
分析は、水中オキシダント濃度と同じ時間に採水した処理水と未処理水を対象に行った。
f. 粒子状有機炭素(POC)
上記DOCサンプルのろ過処理でグラスファイバーフィルターに捕集された懸濁物をサンプルとして分析した。ろ過処理後のグラスファイバーフィルターはアルミホイルに包み、-20℃以下の冷凍庫で保存した。
分析は、フィルターを60℃で4時間以上乾燥させた後、CHN分析計に入れて炭素量を測定した。なお、燃焼処理の後、試水をろ過していないグラスファイバーフィルターをCHN分析計で測定しブランクの恒量値を求めた。
分析は、水中オキシダント濃度と同じ時間に採水した処理水と未処理水を対象に行った。
g. 浮遊物質(TSS)
試験水2 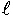 をグラスファイバーフィルター(Whatman社製GF/F)により吸引ろ過後、直ちにフィルターをろ過器から外し、大きめのガラスろ過器にのせた。ガラスろ過器にのせたフィルターは、炭酸アンモニウム水溶液(炭酸アンモニウム35gを蒸留水1 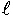 に溶解した3.5%水溶液)10〜20  を3〜4回に分けて吹き付けながら吸引し、海塩等を洗浄した。なお、ブランク用のフィルターも同じ作業を行った。フィルターの秤量は、乾燥機で60℃、2時間乾燥させた後に行った。 分析は、水中オキシダント濃度と同じ時間に採水した処理水と未処理水を対象に行った。
TSSは、次式で求めた。
TSS(mg/  )=(W2-W1-B)/V W1: サンプルろ過前のフィルター重量(mg)
W2: サンプルろ過後のフィルター重量(mg)
B: ブランク補正値
V: 海水ろ過量(  )
h. 50μm以上の水生生物
写真II.2.1-6には、水生生物の濃縮・分析風景を掲載した。
50μm以上の水生生物分析は、未処理水及び処理水ともに各100  採水し、オープニング50μmのメッシュでろ過後、メッシュ上に残った捕集物(以下、試料)をろ過海水により洗い流し50 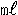 ビーカに集めた。ビーカに集めた試料は、室内で20 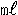 に定容し、定容した試料10 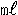 をマイクロピペットでチャンバーに入れ、顕微鏡下で正常な水生生物数を計数した。
i. 50μm未満で10μm以上の水生生物
50μm未満で10μm以上の水生生物は、オープニング50μmのメッシュ通過水をオープニング10μmのメッシュで再ろ過後、試料をろ過海水により50 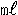 ビーカに集めた。ビーカに集めた試料は、室内で20 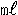 に定容し、定容した試料1及び10 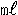 をマイクロピペットでチャンバーに入れ、顕微鏡下で正常な水生生物数を計数した。
写真II.2.1-6 水生生物の濃縮・分析の風景
j. 従属栄養細菌
写真II.2.1-7 バクテリアの塗布作業風景を示した。
従属栄養細菌の作業手順は、滅菌済み100 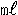 容器に採水後、あらかじめ作成しておいた平板寒天培地(ZoBell 2216E: Marine agar)に塗抹し、水温±10℃の範囲となるよう調整した室温にて培養後、形成されたコロニーを計数した。
k. 大腸菌群
大腸菌群の作業手順は、滅菌済み100 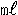 容器に採水後、あらかじめ作成しておいた平板寒天培地(X-GAL)に塗抹し、37℃で培養後形成されたコロニーを計数した。
写真II.2.1-7 バクテリアの塗布作業風景
なお、本実験では、大腸菌群を分析項目としたが、図II.2.1-3には、参考までに大腸菌と大腸菌群の関係を示した。
大腸菌群の代表格であるE.coliは、人や動物の糞便中に多数存在するが、いったん外界に排出されると比較的早く死滅するため自然界における分布は非常に少ない。しかし、E.coliは死滅が速いためE.coliが陰性であるからといって糞便汚染を否定することはできない。これに対してE.coliを包含する大腸菌群に属するCitrobacter、Enterobacter及びKlebsiellaなどは糞便中にも存在するが、人の生活と無関係である土壌や植物、貝類などにも広く分布している。したがって、E.coliを包含する大腸菌群を対象とすることで、安全性を上乗せした判定が可能となる。
図II.2.1-3 大腸菌E.coli(I型)と大腸菌群との関係
|
図中A: 糞便に特異的に存在する
図中B: 糞便から検出されるが、元来土壌や水中を生息場所としている
図中C: 土壌や水中を生息場所としている
|
|
|