|
2・6 蓄電池
| 一次電池 |
マンガン乾電池、水銀乾電池、アルカリ乾電池、銀電池など |
| 二次電池 (蓄電池) |
鉛蓄電池、アルカリ蓄電池、銀亜鉛蓄電池 |
|
このうち一次電池は放電し得る電流の大きさに限度があり電圧が降下してしまった場合は捨てるより仕方がない消耗品的な電源である。
一方二次電池(蓄電池)は外部から充電することにより複数回でも使用でき、かつ、容量もその用途に応じて相当大容量のものが作られるので多く利用される。
現在広く用いられているものは鉛蓄電池とアルカリ蓄電池の2種類であり、特に多く用いられているものは鉛蓄電池である。したがって、以下鉛蓄電池を主として述べることとする。
2枚の鉛板を電極として稀硫酸を入れた電槽中に対立させたものである。これに直流を送ると電池内に化学的変化を起して電極の一方は二酸化鉛となり、他方の極は海綿状の鉛となって発電能力を得る。この現象を蓄電池の充電(Charge)という。そして充電する際、二酸化鉛を生ずる極板を正極板といい、海綿状の鉛となる方の極板を負極板という。
次に充電した蓄電池の両極を導線で連結すると前と反対方向に流れる電流を生ずると共に両極板には不溶性の硫酸鉛を生じ、蓄電池の起電力は次第に減少し遂に流れなくなる。このように電池から電流を取出すことを蓄電池の放電(Discharge)という。
図2.67 鉛蓄電池の基本構造図
電槽(ケース)内に隔離板(セパレータ)挿入し、電解液(以下電液という。)を入れる。一般に負極板の数が、正極板より1枚多くなっている。ケースはエボナイト製、ガラス製、プラスチック製等がある。
極板の構造
| (拡大画面:100KB) |
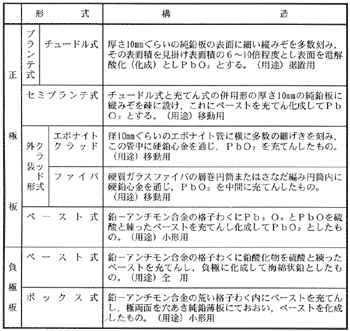 |
鉛蓄電池での問題点は正極板の詰めものが脱落することである。
プランテ式:脱落しにくいが重量が重い。
ペースト式:軽いが脱落が起き易い。
エボナイトクラッド式:寿命が長いが内部抵抗が大きく急速な充放電ができない。
以上のような長短があるが、クラッド式が比較的に多く用いられている。
蓄電池は充電の終期において水の電解作用が始まり、陰極には水素ガスが、一方陽極には酸素ガスが発生する。この発生ガスを放出するための通気孔を兼ねた液口栓を備えた電液槽構造のものをベント形蓄電池と称し、通気孔を持たない密閉構造のものをシール形蓄電池と称している。シール形の代表的な構造は触媒体を備えたもので、特殊媒体により発生ガスを水に戻す作用を有している。
なお、シール形の中にはコロイド蓄電池と称したものがあるが、これは電液をコロイド(糊)状にしたもので、横に倒しても電液が流出せず、充電時に危険ガスを外部に排出しない特長をもっている。
(1)鉛蓄電池
負極(−)に鉛(Pb)正極(+)に酸化鉛(PbO2)、電液に稀硫酸(H2SO4)を用いている。
| (拡大画面:16KB) |
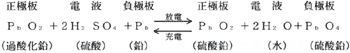 |
普通正常の電圧は1個で2〔V〕が標準である。
(2)アルカリ蓄電池
鉄(Fe)、ニッケル(Ni)系のものとカドミュウム(Cd)、ニッケル(Ni)系の2種類がある。
(i)Fe−Ni系(エジソン電池)
負極(−)に鉄(Fe)、正極(+)に水酸化ニッケル〔Ni(OH)3〕、電液にか性カリ溶液(KOH)を用いている。
| (拡大画面:12KB) |
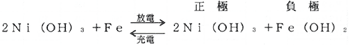 |
(ii)Cd−Ni系(ユングナ電池)
正極と電液は前者と同じで負極はカドミュウム(Cd)を用いている。
| (拡大画面:15KB) |
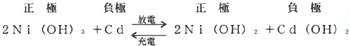 |
正常の電圧は単電池で1.2〜1.35〔V〕位である。
|