|
はじめに
本論文は、65歳以上の老人にみられる主要な脳疾患として、卒中、パーキンソン病、アルツハイマー病の3つを取り上げる。この3つを選んだのは、これらが多数の患者を冒しているためでもあるが、これらが明確に異なる種類の脳疾患の典型であり、したがって、脳神経科学の研究と治療が直面しているさまざまな難問を浮き彫りにしているからでもある。脳卒中は主として血管障害を原発とする疾患であるが、酸素欠乏や外傷に弱いという脳に特有な弱点を明確に呈する。最近の疫学上の発見は、予防的な措置を講ずれば、老化する脳にも非常に効果があることを示している。パーキンソン病は、原因不明の神経系の変性疾患であり、時として外因によって引き起こされる。この疾患は環境と個人のもつ素質の相互作用が脳障害を引き起こすという例である。
第3にアルツハイマー病について論じるのは、これもやはり脳の変性疾患で、工業社会における最もありふれた、かつ社会経済を破壊する慢性障害として急激に増加しつつあるからである。
1.脳卒中
脳卒中は、アメリカでも日本でも、アルツハイマー病に次いで最も多く発生している。しかもこの疾患は、予防措置に関する疫学研究を行って、病気の始まりが遅れ、老人病の発生率が減少したことを示すよい例である。
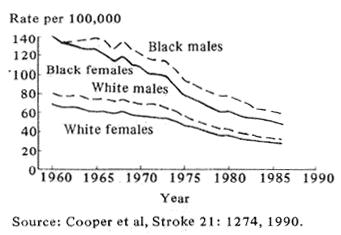
Fig.1 Trends in age adjusted stroke mortality U.S. 1960-86
アメリカにおける脳卒中の発生率は1950年代に低下し始め、この40年間で年齢階級別発生率は確実に減少してきた(図1:Cooper et al.,1990)。このように好ましい変化をみたのは3つの異なった学問的アプローチの結果であろう。第1に、血管系の問題、対照を用いた実験の試み、脳卒中の発生率、ひいては死亡率を減少させるのに大きく影響した。
第2に、血栓溶解剤と呼ばれる急性凝血を溶かす薬剤が新たに発見され、実験段階ではあるが、急性脳卒中による損傷をなくす、あるいは少なくすることが可能になった。最後に、最近の脳の薬理学と生化学の進歩により、脳卒中が起こった後に投与する薬物療法は、二次的な酸素欠乏による脳への危険を減少させる可能性があることが分かってきた。
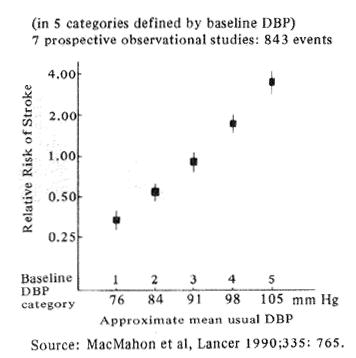
Fig. 2 Stroke and usual diastolic blood pressure (DBP) in a large epidemiologic meta analysis
40年も前に始まった疫学研究は、慢性高血圧症が脳卒中の原因として深い関係があることを示唆した。この関係は、図2にみられるMacMahon'sの42万人についての包括的解析により最近再確認された。このデータでは脳卒中と拡張期血圧が直接関係していることが立証されている(すなわち、血圧が80と105では脳卒中発病の危険性は8倍にも増えている)。同じ研究でCollinsら(1990)はどんなに重度の高血圧症でも、治療により平均血圧をわずか6mmHg下げれば将来の脳卒中の確率はほぼ42%も減少することを示した。疫学研究はまた、喫煙が脳卒中の原因となること、そして禁煙すれば、将来の脳卒中のリスクは、少なくとも高血圧の治療と同程度に低下することを立証した。アメリカで行われた大規模な解析研究の2つのうち、1つはマサチューセッツ州フラミンガムでの長期研究の一貫として、Wolf(1988)が行ったもので、もう1つはCo1ditz(1988)が看護婦の大規模集団について行った900,000人/年を超える研究である。これらによると、中等度の喫煙は、男性の脳卒中リスクを少なくとも2倍にし、女性では350%も増加させる。少なくとも5年間の追跡研究の枠内においては、リスクの増大は2年間の禁煙によって解消された。
同様に、疫学研究により薬理的予防措置を取ると脳卒中の危険性が少なくなることが立証されている。北アメリカとヨーロッパにおいて29,OOO人の患者について行われた大規模な臨床試験(抗血小板共同研究、1988)の分析要約によると、血小板抑制剤のアスピリンは、一次的発作ではなく、二次的脳卒中を引き起こす危険性を減少させるのに効果がある。この予防効果は実に27%にも達している。またアスピリンと新たに開発された高価な抗血小板剤「ティクロピジン」との比較研究では、二次的な脳卒中の予防がこれより少し多い30%だけできるとしている(Gent,1989/Haas,1989)。ただこれにも弱点があり、ティクロピジンを使用した患者の1%に重度の好中球減少症が発生する。
最近行われた人規模な対照臨床試験では、抗凝血剤がきわめて危険な病状にある患者の脳卒中防止に効果があることを証明した。過去の調査により、抗凝血剤がリューマチ性の心臓病による慢性心房性細動に対し、大きな役割を果たすことを立証したが、たの心疾患による心房性細動の治療については疑問が残っている。
デンマークとアメリカとの共同研究では、ワルファリンあるいはASAが、慢性非リューマチ性心房性細動の患者における脳卒中のリスクを低下させることを示した。デンマークの研究(Petersonら、1990)はアスピリンではなくワルファリンが慢性心房性細動の患者における脳卒中のリスクを低下させることを発見し、アメリカの研究(心房性細動の脳卒中予防研究調査班、1990)は、ワルファリン、アスピリンの双方が75歳未満の患者の場合、80%以上の率で心房性細動の患者における脳卒中のリスクを減じることを発見した。ASAおよびワルファリンの効果については、この研究では確認されてはいないが、アスピリンが75歳以上の人にはほとんど効果がないということはいえる、図3は、24か月間にわたって偽薬を与えられたグループと、ASA、ワリフアリンを投与された心房性細動の患者グループで発生した脳卒中ないし脳卒中類似症状を呈する件数を比較したものである。
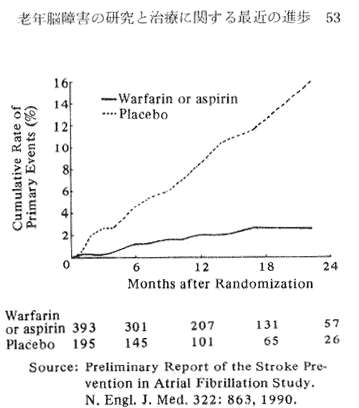
Fig. 3 Rates of stroke or systemic embolism (primary events) in patients given Warfarin or Aspirin (solid, lower curve) or placebo (dotted upper curve)

Table 1 TPA in acute stroke
さてここで血栓溶解剤に関する最近の臨床研究に触れることとしたい。この薬剤は脳損傷を防ぐため、動脈内の血栓を溶かすことをねらいとしている。NIHがスポンサーとなって行われた組織プラスミノゲン活性剤(t-PA)の第1回公開試験では、持続性脳卒中症状が始まってから3時間以内にこの薬剤で治療を受けた90人の患者について良い結果が出た。これらの患者には高血圧症は1人もおらず、全員凝血機能は正常で、治療前のCTスキャンでは脳出血の形跡はだれにもみられなかった。3時間以内に治療を受けた90人の患者の40%は臨床的にみても、CTによる梗塞の程度の検査結果でも大幅な改善を示した(表1)。さらに、症状が始まって90分以内に治療を受けた74人のうち20人はほとんど即時に劇的な改善をみせた。4人の患者は脳出血を併発、1人はその結果死亡、残る3人は脳卒中が直接の原因となって亡くなった。この予備試験では、臨床的な結果も死亡率の数字もともに、コーネル・データバンクの病歴対照データから予測されたものよりはるかによかった。脳卒中の結果は、対象となる集団により大幅に異なり得るので、前述の第一印象を確かめるべくNIHにより対照試験が現在行われている。
過去数年間に脳卒中の細胞生物学の解析に関し多くの研究が行われ、その結果に新しい治療法がいくつも試みられている(Plum,Levy,1991)。
脳動脈血栓症または心拍停止に続いて起こる酸素欠乏により脳細胞内のミトコンドリア・エネルギー工場は極めて短時間で閉鎖に追い込まれる。にもかかわらず、種々の研究によれば、1時間以内に循環が回復されれば、そのまま放置すれば起こる脳障害をかなりの程度まで防ぎ得るのである。それより遅くても発作後2ないし3時間以内に循環が回復されれば、発作の程度が小さくてすむようである。血栓溶解剤が迅速に注射できる場合を除き、動脈の循環再開を図ることは、処置のための時間枠が限られているので技術的に困難である。
上記の問題、機会にかんがみて、研究者らは組織培養についてのいくつかの基礎実験を動物を用いて行い、虚血時に影響を受け安い脳細胞の4つの主要な領域について研究を行った。これらは、?@組織内の血流をよくしカルシウムブロッカーがニューロンに入って毒性を発現しないようにするためのカルシウムブロッカーの開発と試験、?A興奮性神経伝達物質がニューロンをたたかないようにするニューロンレセプターブロッカーの開発、?B虚血時と後でニューロン中の乳酸性アシドーシスが働いて、致死効果を呈しないようにするバッファーを提供すること、?C致命的な組織のペロキシデーションを開始する遊離酸素原子の清浄剤または脱イオン剤の提供である。それらの研究はすべて有望な結果を得たが、脳卒中の臨床症状にはあまり効果がみられなかった。
2.脳変性疾患
パーキンソン病とアルツハイマー病を例にとって、脳変性疾患に関する最近の脳神経科学研究の進歩について論じたい。最初に脳神経科学にあまり詳しくない人々のために、脳という器官、特にヒトの脳は見かけよりもはるかに複雑な臓器であるということを説明したい。実際脳は、心臓や肺や肝臓のような、均一な組織の固まりとはまるで違っている。ヒトの精神活動と機能のすべてを究極的に支配している、脳というコンパクトな器官は、アジアの独立国の数よりも多くの解剖学的・科学的に異なった構成要素を、自然界で最も能率的な方法で、メロン1個ほどの保護された空間のなかに詰め込んだものなのである。
脳のなかのある系は物を見、ある系は物を聞き、ある系は匂いを嗅ぎ、また別の系は、バランスを調節したり、体温を調節したり、考えたり、話をしたり、学習したりしている。しかも、1つの単位として行動するには、大型の集積回路がこれらの機能をまとめあげなければならない。脳を構成する系は、それぞれが特定の遺伝子によって定まる個別の規則に従って発達し、遺伝的に予定された内在的なプログラムに従って徐々に劣化する。また、特定の内在・外来毒素などの脅威に対して、しばしば特殊な感受性や抵抗を示すことがある。中枢神経系の変性疾患の大半は、その選択的な遺伝的発達に支配された感受性を反映したものであり、脳または脊髄に存在する系の一部のみを冒す。その結果、年齢に伴う自然な劣化が老年期の神経科学的問題の共通の特徴ではあるが、大半の変性疾患の初期段階では、それぞれ独特な臨床的特徴と病変がみられる。
現時点では、これらの特徴を発生させる一般的原理は、ほとんど分かっていないため、そのなぞを解明しようとする科学者らは、個々の疾患を追求しつつ、1つの問題への答が別の疾患における問題についても広く答えてくれることを期待する以外には、あまり選択の余地をもっていない。例えばパーキンソン病とアルツハイマー病の問には、共通する神経病理学的な異常が起こり得るが、このような共通分母の存在は珍しいことであり、脳の特定の下部系統がなぜ、どのようにして他の下部系統よりも老化に敏感なのかという分子神経科学的理解には、まだ程遠い状況だといわねばならない。
3.パーキンソン病
パーキンソン病は、少なくとも初期においては、脳幹上部の深部に位置する黒質中のごく一部のメラニン含有神経細胞が早期進行性機能不全を起こし、死んでいる状況を反映している。冒されたニューロンは、カテコールアミン系神経伝達物質のドパミンを産生し、線条体に達する黒質線条体路とよばれる出力線維に、この伝達物質を送り出す。線条体は基底神経節の一部であり、正常な随意運動の統合と調節を行う大型の皮質下部の核である。線条体のなかでは、ドパミンが調節的・抑制的伝達物質として作用し、緩衝機能を発揮している。
パーキンソン病の病因や細胞死のメカニズム、なぜパーキンソン病が苛借なく進行するのか、これらの問題はまだ解明されていない。しかし後期の段階で、パーキンソン病でみられる異常のいくつかが、アルツハイマー病のものと一致することは重要な点である。

Table 2 Parkinson's disease-predisposing or causative factors
アルツハイマー病と同様、パーキンソン病も発病率にある程度の家族性があるが、一卵性双生児が二卵性双生児よりもり患率が高いわけではないので、遺伝子因子が大きいということはない(表2)。
しかし、アルツハイマー病とは異なり、パーキンソン病は、いくつかの外因条件で促進されることがある。1920年のインフルエンザ流行後の40年間で徐々にではあるがパーキンソン病が多数発生したことは、ウイルスが本疾患の原因または素因と成り得ることを示唆している。疫学研究では、それ以後そのような発生が見いだされていないため、生物学的にユニークな病原因子であったと考えられる。中等度の酸素欠乏は、特に数時間にわたって持続した場合、パーキンソン病の症状・徴候を誘発することがあるが、このような患者は線条体に肉眼でみられる梗塞を起こしているのが普通であり、細胞レベルでのメカニズムを正確に特定する必要はない。数年前、街頭で売られていたMPTPとよばれるテトラヒドロピリジン系の非合法的な薬物が、わずかな量で重度のパーキンソン病と同じ解剖学的・薬理学的な異常をヒトで引き起こすことが発見された。この発見は、パーキンソン病の原因を幅広く解明するための手がかりとなるのではないかと大きな関心を呼び起こした。研究により、MPTPは、モノアミンオキシダーゼBによって別の化合物、フェニルピリジン(MPP)に変換されることが発見された。この物質が、今度は黒質のドパミン作動性ニューロンのミトコンドリア内部に輸送され、呼吸を阻害して、カルシウムの蓄積濃度を致死的なレベルにまで、上昇させる。
その他の環境毒物もまた、同様に脳内に入り、黒質など感受性のある領域に作用するという説が提案されている。臨床試験から得られたいくつかの証拠によると、アミンオキシダーゼBを阻害するセレゲリンが、自然なドパミン分解を遅らせ、結果としてドパミンの作用を長引かせて、黒質細胞を環境毒物から保護するのであろうと考えられている。そうでないとすれば、毒物の知識が発達したおかげで、将来の治療法をテストするのにきわめてよい動物モデルを作り出すことはできても、環境中にMPTP類似の化学物質を見つけ出そうとした大規模な研究は徒労に終わっていた。
何人かの学者は、自然発症のパーキンソン症候群の猿または患者の、MPTPが壊れた脳のなかで死あるいは死につつある黒質ニューロンを新しい細胞と置き換える試みを行っている。当初、患者または動物自身の副腎組織を病気にかかっている基底神経節に移植するという、自家移植が試みられた。これらの実験の結果はさまざまであったが、患者にとっては時に致命的なものになり、この結果、臨床での副腎移植は大幅に減少した。最近、Lindvall,Bjorklandらスウェーデンの研究陣(1990)により、ヒト胎児の黒質の一部を、パーキンソン病患者2例のドパミン欠失被殼に移植するという、綿密な実験が行われた。研究の初期段階では、この移植組織は生着し、欠損酵素を合成することが示唆された。
少なくとも患者のうち1人は、陽電子放射型断層撮影で基底神経節中のドパミン受容体の活動が活発になったことが認められ、臨床的にも薬理学的にも画期的な改善をみせている。もちろん、この実験は他の症例でも検証されなければならない。また、ヒトの胎児の物質を脳に移植するという考えそのものが、倫理的には物議をかもすであろう。結果がどのようなものになるにせよ、脳中の細胞再生を容易にし、脳への神経細胞移植を促進するための実際的な手法を作り出す道を発見するうえで、この実験は強い刺激を与えた。私どものコーネル研究所は、脊椎動物の脳神経細胞を組織培養で存続させ、増殖させる問題に精力的に取り組んでいる(Goldman,1990)。すでに、ある種の神経組織栄養物質の助けを借りることにより、脊椎動物の脳神経細胞を刺激して組織培養で分裂させることが可能である点を確認している。将来、組織培養で特定の種類の神経細胞を次から次へと分裂させ増殖させることが大規模にでき、この細胞を必要とする数多くの患者の死んでいく神経細胞と置き換えることのできる日がくるという夢がある。
4.アルツハイマー病
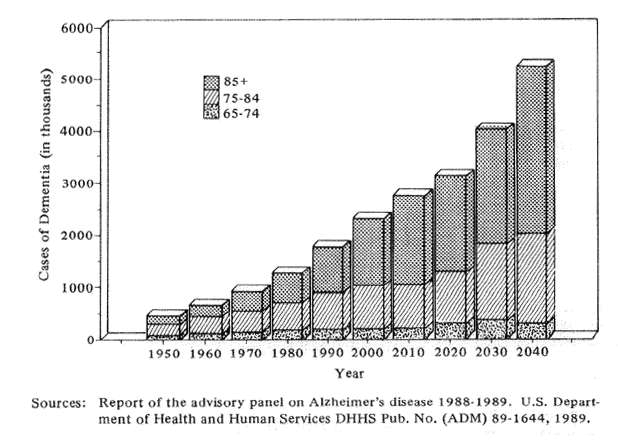
Fig. 4 Estimated numbers of cases of severe dementia by age in the U.S. population,1950-2040
本疾患は、その規模において新たな疫病とたとえられる難病であり、急速に高齢化が進んでいる先進工業国においては、医療制度を圧迫し、社会サービスシステムを枯渇させようとしている。問題はたいへん深刻であり、1980年のアメリカにおいては約130万人がアルツハイマー病ないし関連の痴呆症で障害を起こしていると推計されている。1990年までにアルツハイマー症患者は約180万人に達し、10年間に38%という脅威的な増加を記録した(図4)。これらの数値を既知の保健・人口統計によって推定すると、アメリカの痴呆による障害者は、2040年までに1980年の数値のほぼ400%に増加すると予想される。この数値は、北アメリカのみならず日本や北欧にとっても大きな社会的・経済的問題をはらんだ数値といえる。
効果的な予防手段が発見できないとすれば、いまから50年のうちにアルツハイマー病のために投下される費用と財政負担は他のすべてのヘルス・ケアの二一ズを合わせたものより大きくなる恐れがある。
アルツハイマー病とは、ある種の脳細胞の神経解剖学上の部分的変性のことであり、まだ比較的健康な肉体にかなり典型的な精神的変化を伴う疾患である。アルツハイマー病は疾患であるとも疾患でないともいえる。確かなことは、アルツハイマー病の経過が加齢と不可分に結びついていることである。ヒトのみならず、哺乳動物のヒヒやラットといった異種動物であっても、程度は軽いものの、高齢になると同じような行動的・形態的変化が見いだされるということは、今後の研究の発展にとって、動物実験による解明が可能であるという非常に重要な意味をもっている。
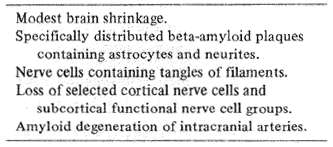
Table 3 Anatomy of Alzheimer's disease
解剖学は疾患が脳の特定の系を冒す傾向を最初に教えてくれるため、脳神経科学の道路地図のようなものである。アルツハイマー病は、4つの主な解剖学的異常を伴っている(表3)。それは、?@大脳半球、特に前頭葉・頭頂葉の連合野、海馬および桃に発生するβ一アミロイドと呼ばれる特殊なタンパク質を含有するプラーク(小さい斑点)。?A神経細胞原線維に絡み合ったような外見をみせる可視的な異常。?B大脳皮質の辺縁領域と皮質下の核におけるニューロンの消失。?C頭蓋内血管に影響を及ぼすβ−アミロイドの変性(これらの完全な意味はほとんど解明されていないが)である。
脳神経科学研究は、アルツハイマー病の発生機序への手がかりと思われるこれら4つの主な解剖学上の異常を積極的に追究してきた。この件については後で触れることとして、ここでは病因について述べておきたい。

Table 4 Proposed etiologies of Alzheimer's disease
現在、本疾患の病因を示す手がかりは、ごくわずかしか存在しない(表4)。アルツハイマー病は世界的にみてほぼ同年齢で発生しているため、環境的因子は比較的重要ではないように思われる。前もって細胞の増殖と死のプログラムを規定する遺伝的因子が重要な役割を果たしている。この事前のプログラムどおり細胞死が起こるという原理は、初期の正常な脳の発達過程で如実に示されているが、これはすべての年齢でも起こることである。胎児期の哺乳類の脳は、必要とされるよりもはるかに多くのニューロンを産生する。内在的な遺伝子支配によるプログラムが、相当数の過剰なニューロンを除去し、出産時までに徐々に将来の必要性に合致した神経ネットワークをつくり、調整していく。しかしながら、このプログラムされた細胞死という過程はヒトの正常な発達のためには必要なものではあるが、年齢が進むにつれて人間の敵となり、内臓の維持管理に必要な部分は残すが、神経系の重要な部分を過剰に消去してしまう。この細胞死の速度については論議があるが、すべてのヒトの脳は、25歳以降になると神経細胞を喪失するようにプログラムされている。神経系がこのような損失を自然に補充できないのは、禿げてしまった頭に新しい毛髪がもはや生えないのとほぼ同様である。しかし、老化の過程でアルツハイマー病が現れるとしても、その時期を決定するのは他のメカニズムのはずである。アルツハイマー病への遺伝的影響に関しては、いくつかの研究から確たる証拠が上げられている(表5)。人口学研究によれば、アルツハイマー病患者の1親等の親族の半分が、85歳ごろまでにこの病気にかかっていることが分かった。この数値は、家族歴のない同年齢の対照群に比して、少なくとも15%は高いが、しかしこの後者の数値でさえもおそらくは遺伝が関与した素因が普遍的に存在していることを意味している。遺伝的因子が存在するという印象は、老人およびその家族に接している医師であるならば、臨床経験から直観的に知っているにもかかわらず、具体的なアルツハイマーの遺伝子または遺伝子群を確定することに成功していない。

Table 5 Genetic factors in Alzheimer's disease (AD)
当初、遺伝学者らは21番染色体に病原遺伝子が存在するのではないかと仮定した。なぜならば、21番染色体が3本あるダウン症候群の患者のすべてが、30歳までにアルツハイマーに特有の神経解剖学的変化をみせたからである。そして、常染色体優性の若年アルツハイマー病が報告された特定の家系に、21番染色体上に明らかに異常な染色体マーカーのあることが確認されたことで、上記の仮説は支持されたかのようにみえた。しかし、この染色体の異常はその他の老齢の患者とその家族に共通するものではなかった。この点で興味深いことは、アミロイド・べ一夕・タンパク質(amyloid beta protein:ABP)前駆体とよばれるタンパク質を合成する遺伝子が21番染色体上に存在することである。ABP前駆体の断片は、アルツハイマー病の老人斑の核や頭蓋内血管中に沈着するアミロイドを形成している。これらの異常はどちらも高齢化と本疾患の主要なマーカーとなっている。

Table 6 Alzheimer amyloid beta protein (ABP)
脳アミロイドが、アルツハイマー病の病因の主要な科学的研究の焦点となっている(表6)。アルツハイマー病患者に多量に出現するアミロイド前駆体タンパク(amyloid precursor protein:APP)は、進化の途上で非常によく保存されており、哺乳類を含む多数の動物種に分布している(Selkoe,1990)。この発見は、APPが未解明ではあるが強力な機能的特性を有していることを意味している。APPは、小さいほうの端が細胞内に位置し、大きいほうの端が外にぶら下がるようにして細胞膜をまたぐという特殊な構造をもっている。さらに、大きいほうの端は、時にはある種の挿人物を抱えており、それは既知のプロテアーゼ阻害剤であることがある。APPの細胞外部分の分子配列をみると、あるものは傷を癒すのに役立ち、または成長因子としての働きさえもっている可能性が示唆される。いずれにせよ、APPは、人体内において正常に機能するタンパクであり、ダウン症候群の患者および常染色体優性のアルツハイマー病患者の脳に、過剰に出現するのである。
正常な老化と異常な老化の双方において、脳中にβ−アミロイドが過剰に出現する現象は、アルツハイマー病の老人斑が本格的に発達する前に先行して起こっている。さらに、老人斑も神経原線維変化もともに、70歳以上で痴呆症状を全く呈していない健常老人の50〜75%に見いだされる。大きく異なるのはこの変化は典型的アルツハイマー病患者よりも健常老人のほうが少ないということだけである。現在のところ、アルツハイマー病の老人斑中の退化したアミロイド・タンパク質が変成を引き起こす一次的な役目を演じているのか、それとも副次的な役割を演じているのかを評価するのは難しい。ダウン症候群、21番染色体欠損を伴う家族性アルツハイマー病、それに健常老人について確認されたことは、脳アミロイドの量は21番染色体上のタンパク遺伝子の作用に直接関係しているが、アルツハイマー病には単に二次的に関係しているだけであるとみられる。脳中の異常なABPは血管から発せられるのかあるいは神経細胞それ自体からか、またタンパク質がとにかく神経毒性なのかどうかは今後の解明をまたなければならない。
脳の大きな錐体ニューロンのなかに対を成したらせん状線維として証明されている神経原線維変化は、アルツハイマー病の存在を示すもう1つの顕著な病理学的マーカーである。この変化が本疾患の一次的な異常を反映したものかあるいは単に細胞質タンパク質の変性産物であって、すでに死につつある細胞の副次的変化を表しているのかは、長い間議論されてきた。同様な細胞の変化がピック病、進行性核上麻痺およびある種の筋萎縮性側索硬化症などの神経変性にも生じることから、これらは初期のもっと特異的な異常に対する副次的な反応を意味するようである。このもつれ合う2本のねじれた螺旋状線維の少なくとも一部は、新たに生じた疾病特有の化合物というよりは、むしろt−タンパク質の異常変種から成っていることが確認されている。
ニューロンの変性および特定の脳ニューロン系の死は、アルツハイマー病の神経病理を明確に規定する。アルツハイマー病においては、神経原線維変化や顆粒空胞変性を含有する大きな錐体細胞は、いくつかの皮質・頭頂連合野の皮質の領域で広範囲に失われている。初期に目だって細胞欠損が生じる領域は、コリン作動性の基底前脳核と、程度は低いが、非コリン作動性の青班核および脳幹のセロトニン作動性の脊髄・上側縫線核である。
これらが病気の原因として働く役割は議論を呼ぶところであるが、解剖学による研究の結果では、これらの核は皮質下に自立して存在し、□ばし状の形をしているが、アルツハイマー病においてはしばしば退化することが強調されている。Bowenら(1976)とDaviesとMaloney(1976)が最初に行ったアルツハイマー病患者の脳に関する系統的な神経科学研究では、人間の大脳と周辺の皮質のなかのアセチルコリン受容体に著しい選択的衰退が起こることが立証された。その後間もなくWhitehouseらが死後のアルツハイマー脳中でコリン作動性基底前脳核領域や斜体領域および内側中隔核に広範な細胞欠損が起こることを述べている(1982)。これらの深部の核は大脳皮質に向かって広くび漫性に突き出している。アトロピン様の薬剤による薬理的なコリン作動性神経ブロックが時にヒト、特に老人において記憶の欠損と混乱を引き起こすことが既に知られている。さらにBjorklandとGageとは、げっ歯類の基底前脳中隔領域の変性が実質的な記憶障害が引き起し、さらにこれを破壊すると悪化することを立証した(Bartus et al.,1982)。
病気の原因機序が判明せずとも、医者は症状の緩解をもたらす手段を発見しようとする。パーキンソン病についてもCotziasが同じような努力をし、D-LDOPAを徐々に増やし、大量に投与することで成功した。ヒトではアルツハイマー病をコリン作動薬や同種の薬剤で治療しようと努力はしているが、ほとんど臨床的な改善をもたらされてはいない。しかし、動物実験においてはさらによい結果が発見できそうである。
Nillsonらの研究にその例がみられる(1990)。彼らは、コリン作動性とセロトニン作動性の両方の脳細胞群を除去した若年のラットが老齢動物と同様の形で、急速に記憶障害と方向感覚の低下を引き起こすことを確認した。欠損した神経伝達物質の代わりに海馬に適切な代替細胞を移植することによって、動物たちが正常な動作をするようになったが、これは対照動物は自然に自己コントロールを回復させたのではなく、あくまでもなんらかの操作を加えることによって回復したのである。これらの実験は興味深いが、細胞の脳移植が退行型の神経疾患を治すことは、まだ不可能であることを示している。できることは、自然に存在する成長因子や栄養因子がもつ抑制力により、これらの破壊的な状態の土台となっている神経細胞の衰退を遅らせるか止める可能性を追究することである。
5.神経栄養因子と老化脳
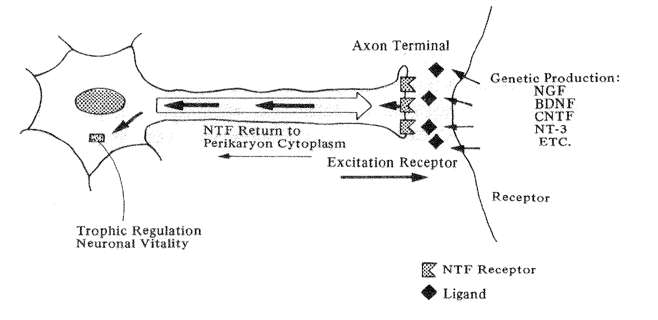
Fig. 5 Diagramatic example of the actions of neurotrophic factors
(Orthodromic excitation from the axon terminal stimulates the release of neurotrophic factor(s) from the receptor which travel back up the axon to affect the nerve cell body.)
神経栄養因子の研究を方向づける仮定として、老化によって引き起こされる神経細胞の退化は必ずしも本来有するメカニズムの一次的衰退を反映するものではなく、標的細胞からの逆刺激がなくなることにより起こるのではないかと考えられている(Snider&Johnson,1989)。図5に示すように、ニューロンの放出軸索はそれが標的とする神経細胞の受容体を刺激する。この神経細胞は代わりに親細胞上の特定の受容体が選定したシナプスを通って神経栄養因子を放出してもどす。分子は軸索を逆に昇って、第一序列ニューロンの活力を維持する細胞質中のリソソーム遺伝戸を増進制御する。

Table 7 Neurotrophic factors
成長因子または栄養因子には既知の重要な機能がいくつかある(表7)。それらは発達中にニューロンの生存を促し、成熟した神経細胞に特有の機能を維持する。また、欠損神経線維の再生を助ける。中央と周辺の神経系ニューロンという特定集団には非常に特異的に存在するが、神経組織のなかで非常に少量に存在するのが通常である。しかし、神経細胞系の存続を維持するためには大きな力をもっている。
この種の因子はVictor HamburgとRita Levi Montalciniが神経成長因子に関する初期の実験を行った1950年以来間接的には立証されている。この因子そのものは1960年迄には直接単離され、その後70年代から80年代にはLevi MontalciniとSidney Cohenがノーベル賞を受賞することになった過程で特徴が明確化された。過去数年間には、科学者は際立った栄養特質を有する新しい分子がいくつも同定されている。
いままでに、組織の発生源別に5つの主要な栄養因子が確認されている。すなわち、神経成長因子(nerve growth factor:NGF)、脳由来神経栄養因子(brain derived neurotrophic factor:BDNF)、線毛神経栄養因子(ciliaryneurotrophic factor:CNTF)、ニューロトロフィン3(neurotrophin-3:NT3)、線維芽成長因子(fibroblast growth factor:FGF)である。
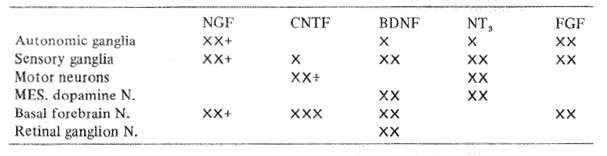
Table 8 Known in vitro (X) or in vivo (+) effects of neurotrophic growth factors
主要な栄養因子のそれぞれ特定の標的を表8に比較して示す。NGFは組織培養においてさまざまな影響を示し、周辺の自律神経節にもっとも強い働きをする。実験ラットのNGFが基底前脳細胞の変性と高齢動物の記憶障害を防ぐことはFischerらによって示された(1986)。これに加えてApfelらは(1990年)抗癌化学療法によって起こる重症の末梢神経障害からNGFがラットを保護することを立証した。
BDNFは組織培養中の脊髄の運動ニューロン、中脳ドパミン作動性・基底前脳コリン作動性ニューロンおよび脊髄の運動ニューロンの生存性を向上させる。NGFでの経験と比べ類似性がみられるとすれば、これらの特質からいってBDNFは成人の老齢による記憶喪失、パーキンソン病、そしておそらく筋萎縮性側索硬化症に対し保護的効果を発揮し得ると思われる。
CNTFは培養で多種のニューロンの発育を促進する、最近Sendtnerらは、CNTFが近位顔面神経部位をもつ動物の場合、顔面神経核の変性を防ぐことを示し、ここでもまた、運動ニューロンについての将来の実験に光明を与えてくれた。
NT3は最も新しく発見されたもので、NGFとBDNFの両者に似たアミノ酸配列が特徴的なポリペプチド成長因子である、これまでのところ、この物質は組織培養において、中枢と末梢の両方で発生期のニューロンの生存性の向上を助けることが知られている。
組織培養と動物実験での発見により、脳由来の神経栄養因子が、終局的にはアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症、そして急性中毒性神経病患者の治療法の手段となる可能性が示されている。
しかし、栄養因子の臨床試験が行われるまでにはまだ多くのことがなされなければならない。これらすべての因子は、全動物種にわたって自然に発生し高度に維持されているペプチドであるため、重大な有害免疫反応を引き起こすことはないと思われる。にもかかわらず、何か別の有害反応が起こる可能性は高い。長く発生期にとどまっていたニューロエンザイムが晩年になって突然火をつけられたら、神経系か系の組織にどのような合併症が起こるかだれも知らない。さらに、これらすべての物質は高分子サイズであり、このことが血液や脳組織中の障害物を通過して狙う標的に達するのに重人な妨げとなる。これらの問題は、すべて評価に時間がかかり、綿密な努力が必要である。アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症や癌などの犠牲者とその家族を取り巻く無力感と絶望感を考えれば、これらの治療試験については迅速に対処することになるだろう。われわれもすでにこの種の問題を取り上げているが、NGFを用いたヒトでの実験を始めることがまもなく可能になりそうである。
文献
l) Antiplatelet Trialist Collaboration: Secondary prevention of vascular disease by prolonged antiplatelet treatment. Brit Med J, 296: 320-331 (1988).
2) Apfel SC, Lipton RB. Arrezo JC, Kessler JA: Neuronotrophic factor rescue of toxic neuropathy. Ann Neurol, 28:220 (1990).
3) Bartus RT, Dean RL, Beer B, Lippa AS: The cholinergic hypothesis of geriatric memory dysfunction. Science, 217:408-417 (1982).
4) Bowen DM, Smith CB, White P, Davison AN: Neurotransmitter-related enzymes and indices of hypoxia in senile dementia and other abiotrophies. Brain, 99:459-496 (1976).
5) Choi DW: Cerebral hypoxia; some new approaches and unanswered questions. J Neurosci., lO:2493-2501 (1990).
6) Colditz GA, Bonita R, Stamfer MJ, et al: Cigarette smoking and risk of stroke in middle aged women. N Engl J Med., 318:937-941 (1988).
7) Collins R, Peto R, MacMahon S, et al: Blood pressure, stroke and coronary artery disease. Part 2. Short term reductions in blood pressure: overview of randomized trials in their epidemiological context, Lancet., 335:827-838 (1990).
8) Cooper R, Sempos C, Shih-Chao H, et al: Slowdown in the decline of stroke mortality in the United States, 1978-1986. Stroke., 21:1274-1279 (1990).
9) Davies P, Maloney AJF: Selective loss of central cholinergic neurons in Alzheimer's disease. Lancet, 2:1403 (1976).
lO) Fischer W, Wictorin K, Bjorklund A, et al: Amelioration of cholinergic neuron atrophy and spatial memory impairment in aged rats by nerve growth factor. Nature, 329:65-68 (1987).
11) Gent M. Blakely JA, Easton JD, et al: The Canadian-American ticlodipine study (CATS) in thromboembolic stroke. Lancet, l:1215-1220 (1989).
12) Goldman S: Neuronal development and migration in explant cultures of the adult canary forebrain. J Neurosci, lO:2931-2939 (1990).
13) Haas WK. Easton JD, Adams HP, et al: A randomized trial comparing ticlodipine hydrochloride with aspirin for the prevention of stroke in high risk patients. N Engl J Med, 321:501-507 (1989).
14) Lindvall O, Brundin P, Widner H, et al: Crafts of fetal dopamine neurons survive and improve motor function in Parkinson's disease. Science, 247:574-579 (1990).
15) MacMahon S, Peto R, Cutler, et al: Blood pressure, stroke and coronary artery disease. Part 1. Prolonged differences in blood pressure and prospective observational studies corrected for the regression dilution bias. Lancet, 335:765-774 (1990).
16) Nillson OG, Brundin P, Bjorkland A: Amelioration of spatial memory impairment by intra hippocampal grafts of mixed septal and raphe tissue in rats with combined cholinergic and serotonergic denervation of the forebrain. Brain Research, 516:193-206 (1990).
l7) Peterson P. Boysen G, Godfredson J, et al: Placebo controlled randomized trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation. Lancet, l:175-179 (1989).
18) Plum F, Levy DE: Preventive and acute therapy of established benefit in stroke. In: J Krieglstein, H Oberpickler (eds), Pharmacology of Cerebral Ischemia; Wissenschaftliche Verlagsgesllschaft mbH, Stuttgart (1991).
19) Selkoe DJ: Deciphering Alzheimer's disease: the amyloid precursor protein yields new clues. Science, 248:l058-l06O (1990). 20) Snider WD, Johnson DM: Neurotrophic molecules. Ann. Neurol., 26:489-506 (1989).
21) Stroke Prevention in Atrial Fibrillation Study Group Investigators: Preliminary report of the stroke prevention in atrial fibrillation study. New Engl J Med, 322:12 (1990).
22) Whitehouse PJ. Price DL, Stuble RG, et al: Alzheimer's and senile dementia: loss of neurons in the basal forebrain. Science, 215:1237-1239 (1982).
23) Wolf PA, D'Agostino RB, Kannel WB, et al: Cigarette smoking as a risk factor for stroke: The Framingham study. JAMA, 259:1025-1029 (1988).
|