
|
(6)バッテリの容量
バッテリから取り出すことができる電気の量をいい、放電する電流(A:アンペア)と放電することができる時間(h:アワー)をかけたもので、アンペア・アワーで表します。
3.放電と充電に伴うバッテリ内部の化学変化
一次電池の場合は一度使用して放電すると再び使用することはできませんが、二次電池の場合は化学的可逆性を持っていて、放電と反対の方向に電気を流すと再び元の状態に戻すことができます。
バッテリの充電・放電の際の化学反応は下記の化学式で示されます。
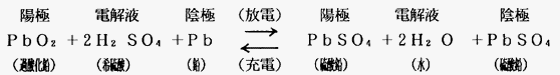
放電
バッテリが外部の回路に接続されて電気が取り出されると、陽極板のPbO2と陰極板のPbは電解液の中の硫酸(H2SO4)と反応して、次第に硫酸鉛(PbSO4)に変わり、電解液は水(H20)に近くなります。さらに放電が続くと、極板は完全に硫酸鉛になり電解液はますます水に近くなり、最後には電気を発生する事ができなくなります。
このような放電を過放電といいます。過放電をすると極板が変質して、充電しても元の状態に戻り難くなるだけでなく、バッテリ故障の原因にもなります。
以上に説明した電解液の化学反応から、電解液の硫酸の濃度を計測することでバッテリの放電量を知ることができるわけです。
自己放電
バッテリは電解液が入った状態で、外部との回路の接続がなくても一日にバッテリの容量の0.5〜1.0%が放電されます。これを自己放電といい、温度が高い程、また電解液の比重が高いほど多くなります。自己放電の原因は
(1)バッテリ内の不純分
バッテリ内に金属不純分が存在すると、金属不純分が局部電池形成して自己放電が行われます。補充水中の不純分も自己放電の原因になりますので注意して下さい。
(2)バッテリ外面での漏電
バッテリの外面が電解液などの導電性の液体で濡れていると、+端子と−端子間に電
前ページ 目次へ 次ページ
|

|