|
b. 気相オゾン濃度
写真II.5.1-3には、気相オゾン濃度計測風景を掲載した。
計測は、注入時オゾン濃度2.5mg/ 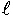 試験時に検知管法で行った。計測のタイミングは、バージに漲水し始めから10、20、30及び40分(バージに200m 3漲水するのに要する時間が40分)後に、送風口の先端で行った。なお、40分後の計測は、マンホール上での直接計測も行った。
写真II.5.1-3 気相オゾン濃度の計測風景
c. 水質分析(DOC・POC・TSS)
溶存有機炭素(DOC)、粒子状有機炭素(POC)及び浮遊物質(TSS)は、注入時オゾン濃度2.5mg/ 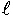 試験時に、未処理原水を対象として行った。 分析方法は、ハイブリッド第1世代処理効果再検討試験と同じ方法である。
d. 水温・塩分・pH・DO・濁度
計測には、水質メータ−を用いた。
表II.5.1-4には、水質メーター(HORIBA社製 U-21XD)の測定原理等を示した。
水温、塩分(Salinity)、水素イオン濃度(pH)、溶存酸素(DO)及び濁度(Turbidity)の計測は、全試験水を対象に行った。
計測方法は、試験海水をバケツに汲み、水質メーター(HORIBA社製 U-21XD)のセンサーを挿入し、表示値を記録することで行った。
| 表II.5.1-4 |
水質メーター(HORIBA社製 U-21XD)の測定原理等 |
| 項目 |
単位 |
測定原理 |
水温
(Water Temperature) |
℃ |
温度の変化に従い抵抗値が大きく変化する熱に敏感なサーミスタ(Thermistor)と呼ばれる抵抗体(Thermally Sensitive Resistor)の性質を利用し測定する。
測定範囲:0〜55℃、分解能:0.01℃ |
塩分
(Salinity) |
PSU |
ある水温における電気伝導率と塩分濃度の間には一定の関係があり、電気伝導率と水温を測定し演算することで相当する塩分濃度を求める。
測定範囲:0〜40PSU、分解能:0.1PSU |
水素イオン濃度
(pH) |
|
試水中に存在する水素イオン(H+)濃度をガラス電極により測定する。ガラス電極法とはガラス電極と比較電極の2本の電極を用い、この2つの電極の間に生じた電圧(電位差)により試水のpHを測定する。
測定範囲:0〜14、分解能:0.01 |
溶存酸素量
(Dissolved Oxygen) |
mg/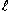 |
酸素透過性隔膜を通過してきた酸素により、酸素透過性隔膜と密着した銀では還元反応、鉛では酸化反応が生じ、2者間の回路を酸素量に応じ流れた電流を利用し測定する。
測定範囲:0〜19.99mg/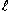 、分解能:0.01 mg/ 、分解能:0.01 mg/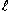 |
| 濁度(Turbidity) |
NTU |
試水中にある濁度成分により散乱した光と透過した光の比率に基づいて測定する。
測定範囲:0〜800NTU、分解能:0.1NTU |
|
e. 50μm以上の水生生物
図II.5.1-2には、従来使用のメッシュと本試験で使用したメッシュサイズの相違を示した。
分析方法はハイブリッド第1世代処理効果再検討試験と同じである。ただし、濃縮に使用するメッシュのオープニングサイズを変更した。従来は、オープニングの一片が50μmのメッシュを使用していたが、2005年7月のMEPC53で確定したG8ガイドライン試験要件で、水生生物の濃縮に使用するメッシュサイズが、オープニングの対角線で50μmと規定されたためである。
| 図II.5.1-2 |
従来使用のメッシュと本試験で使用したメッシュサイズの相違 |
f. 50μm未満で10μm以上の水生生物
50μm未満で10μm以上の水生生物の分析方法は、ハイブリッド第1世代処理効果再検討試験と同じである。ただし、50μm以上の水生生物と同様に、濃縮に使用するメッシュのオープニングサイズを、一片10μmから対角線で10μmに変更して用いた。
g. 従属栄養細菌
従属栄養細菌の分析方法は、ハイブリッド第1世代処理効果再検討試験と同様に、Marine Agar2216培地による平板培養法とした。培養は、20〜24℃で、試験水の採取・接種日から5日後まで行った。
h. 大腸菌群及び大腸菌
大腸菌群及び大腸菌の分析は、ハイブリッド第1世代処理効果再検討試験と同様に、XM-G培地による平板培養法とし、24時間、37℃で培養した。
i. 腸球菌グループ及び腸球菌
分析方法は、腸球菌グループを検出する第一段階と、この分析方法で形成された集落を対象に行う腸球菌を検出する第二段階の分析を行った。
第一段階の分析となる腸球菌グループの検出には、滅菌したメンブレンフィルターで試験水をろ過し、フィルターを寒天平板培地上に置き培養するメンブレンフィルター法で行った。培地は、M-エンテロコッカス寒天培地を使用した。培養は、37℃で48時間行った。
第二段階の分析となる腸球菌の分析は、上記腸球菌グループの分析において形成された各群落を、6.5%塩化ナトリウム濃度のブレインハートインフュージョン培地を入れた96wellカルチャープレートで、45℃、48時間静置培養する方法で行った。
なお、第二段階の腸球菌分析は、2試験ケースのうち、最初に行った注入時オゾン濃度2.5mg/ 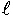 試験時に検出されなかったため、2ケース目の注入時オゾン濃度3.0mg/ 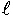 試験では行わなかった。
j. コレラ菌
分析方法は、コレラ菌(Vibrio chorelae)及びその近縁種を検出する第一段階と、この分析方法で形成された集落を対象に、コレラ菌O1及びO139を含むVibrio属を検出する第二段階の分析を行った。また、第二段階で検出されたものは、毒素産生性コレラ菌O1及びO139の計数を行う予定であったが、第二段階の分析で検出されなかったために実施しなかった。
第一段階の分析となるコレラ菌及びその近縁種の検出には、メンブレンフィルター法を用いた。培地は、チオ硫酸−クエン酸−胆汁酸−白糖(TCBS)平板寒天培地を使用した。培養は、37℃で24時間行った。
第二段階の分析となるコレラ菌O1及びO139を含むVibrio属の検出は、上記の第一段階(「a. コレラ菌(Vibrio chorelae)」)で検出された各集落を対象に、無塩アルカリ性ペプトン水を入れた96wellカルチャープレートを用い、37℃で16時間静置培養で行った。
第二段階となる Vibrio属の分析は、2試験ケースのうち、最初に行った注入時オゾン濃度2.5mg/ 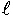 試験時に検出されなかったため、2ケース目の注入時オゾン濃度3.0mg/  試験では行わなかった。 |