
|
4・2 金属腐食
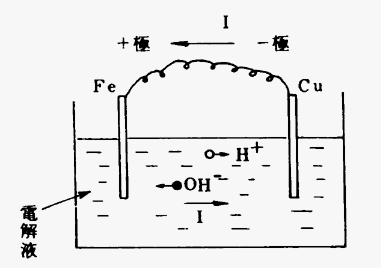
図4・2
図4・2のように電解液中にイオン化傾向のある2種の純粋金属例えば、鉄Feと銅Cuを対向させ、これらを図のように導体(電線)で接続すれば矢印の方向に電流が折れる。これは一種の電池作用といわれる。
これは次の反応が考えられる。
電解液:H20→H+イオン+(OH)-イオン
陽極鉄(Fe)反応:Fe++2(OH)-→Fe(OH)2
陰極銅(Cu)反応:2H++2e→H2
1/2 O2+H20+2e→2(OH)-
(註:eは電子のもつ電荷の絶対値を示す。)
このことは、陽極では水酸化第一鉄(青錆)を生じ、陰極では水素ガス及び水酸イオンを生じている。さらに水中の酸素によって水酸化第二鉄となって赤錆ができる。
また、鉄とアルミニウムを同様に接触しておいた場合にも、上記の原理に基づいてアルミニウムが腐食する。
また、亜鉛板(Zn)中に綱(Cu)の小片が存在すれば、図4・3のように亜鉛と銅との間に局部電池ができ、電流が矢の方向に流れ、亜鉛の腐食は銅と接触部で大きくなる。
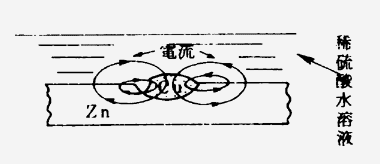
図4・3
このように、異種金属が水溶液中にあって接触していれば、局部電池作用によって一方が腐食する。一般にイオン化傾向の大きい金属の方が腐食される。
注:イオン化傾向の大きいものは早なる金属で陽極として働き、これに反してイオン化傾向の小なるものは卑なる金属として働く。
(腐食しやすい電位卑)
Mg>Mg合金>Zn>A1>Cd>軟綱>鋳鋼>Ni Resist>13%Crステンレス410>Cu>シリコン>ブロンズ途中省略(カゾーディック電位貴)
前ページ 目次へ 次ページ
|

|